Innehållsförteckning för den här artikeln:
1. Utveckling av aminosyror
2. Strukturella egenskaper
3. Kemisk sammansättning
4. klassificering
5. Syntes
6. fysikalisk -kemiska egenskaper
7. Toxicitet
8. Antimikrobiell aktivitet
9. reologiska egenskaper
10. Ansökningar inom kosmetisk industri
11. Applikationer i vardagliga kosmetika
Aminosyratenser (AAS)är en klass av ytaktiva medel som bildas genom att kombinera hydrofoba grupper med en eller flera aminosyror. I detta fall kan aminosyrorna vara syntetiska eller härledas från proteinhydrolysat eller liknande förnybara källor. Denna artikel täcker detaljerna för de flesta tillgängliga syntetiska rutter för AAS och effekten av olika vägar på de fysikalisk -kemiska egenskaperna hos slutprodukterna, inklusive löslighet, dispersionsstabilitet, toxicitet och biologiskt nedbrytbarhet. Som en klass av ytaktiva ämnen i ökande efterfrågan erbjuder mångsidigheten av AAS på grund av deras variabla struktur ett stort antal kommersiella möjligheter.
Med tanke på att ytaktiva ämnen används allmänt i tvättmedel, emulgatorer, korrosionshämmare, återhämtning av olja och läkemedel har forskare aldrig upphört att uppmärksamma ytaktiva medel.
Tyrfaktiva medel är de mest representativa kemiska produkterna som konsumeras i stora mängder dagligen runt om i världen och har haft en negativ inverkan på vattenmiljön.Studier har visat att den utbredda användningen av traditionella ytaktiva medel kan ha en negativ inverkan på miljön.
Idag är icke-toxicitet, biologiskt nedbrytbarhet och biokompatibilitet nästan lika viktiga för konsumenterna som ytaktiva ämnen och prestanda.
Biosurfaktanter är miljövänliga hållbara ytaktiva medel som naturligt syntetiseras av mikroorganismer som bakterier, svampar och jäst eller utsöndras extracellulärt.Därför kan biosurfaktanter också framställas genom molekylär design för att härma naturliga amfifila strukturer, såsom fosfolipider, alkylglykosider och acylaminosyror.
Aminosyratenser (AAS)är en av de typiska ytaktiva ämnena, vanligtvis producerade från djur eller jordbruks härledda råvaror. Under de senaste två decennierna har AAS väckt mycket intresse från forskare som nya ytaktiva ämnen, inte bara för att de kan syntetiseras från förnybara resurser, utan också för att AAS är lätt nedbrytbara och har ofarliga biprodukter, vilket gör dem säkrare för miljön.
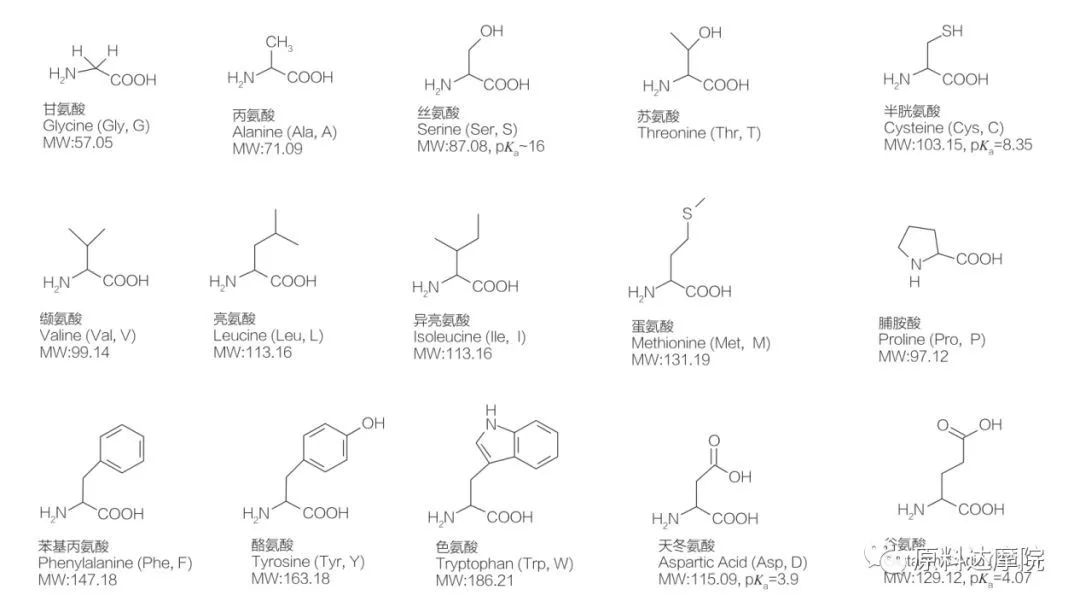
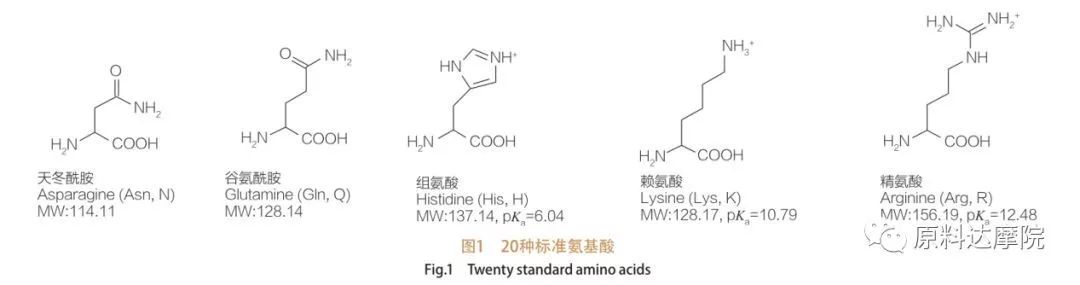
AAS kan definieras som en klass av ytaktiva medel som består av aminosyror som innehåller aminosyragrupper (HO 2 C-CHR-NH 2) eller aminosyrarester (HO 2 C-CHR-NH-). De två funktionella regionerna av aminosyror möjliggör härledningen av en mängd olika ytaktiva ämnen. Totalt 20 standardproteinogena aminosyror är kända för att existera i naturen och ansvarar för alla fysiologiska reaktioner inom tillväxt och livsaktiviteter. De skiljer sig endast från varandra enligt återstoden R (figur 1, PK A är den negativa logaritmen för syradissociationskonstanten för lösningen). Vissa är icke-polära och hydrofoba, andra är polära och hydrofila, andra är grundläggande och andra är sura.
Eftersom aminosyror är förnybara föreningar har ytaktiva medel syntetiserade från aminosyror också en hög potential att bli hållbar och miljövänlig. Den enkla och naturliga strukturen, låg toxiciteten och snabb biologisk nedbrytbarhet gör dem ofta överlägsna konventionella ytaktiva medel. Med användning av förnybara råvaror (t.ex. aminosyror och vegetabiliska oljor) kan AAS produceras med olika bioteknologiska rutter och kemiska rutter.
I början av 1900 -talet upptäcktes först aminosyror att användas som substrat för syntes av ytaktiva medel.AAS användes huvudsakligen som konserveringsmedel i farmaceutiska och kosmetiska formuleringar.Dessutom befanns AAS vara biologiskt aktiva mot en mängd olika sjukdomsframkallande bakterier, tumörer och virus. 1988 genererade tillgängligheten av lågkostnad AAS forskningsintresse för ytaktivitet. Idag, med utvecklingen av bioteknik, kan vissa aminosyror också syntetiseras kommersiellt i stor skala med jäst, vilket indirekt bevisar att AAS -produktionen är mer miljövänlig.
01 Utveckling av aminosyror
Redan i början av 1800 -talet, när naturligt förekommande aminosyror först upptäcktes, förutsågs deras strukturer vara extremt värdefulla - användbara som råvaror för framställning av amfifiler. Den första studien om syntesen av AAS rapporterades av Bondi 1909.
I den studien infördes N-acylglycin och N-acylalanin som hydrofila grupper för ytaktiva medel. Efterföljande arbete involverade syntesen av lipoaminosyror (AAS) med användning av glycin och alanin och Hentrich et al. publicerade en serie fynd,inklusive den första patentansökan, om användning av acylsarkosinat och acylaspartatsalter som ytaktiva medel i hushållens rengöringsprodukter (t.ex. schampon, tvättmedel och tandkräkter).Därefter undersökte många forskare syntesen och fysikalisk -kemiska egenskaper hos acylaminosyror. Hittills har en stor mängd litteratur publicerats om syntes, egenskaper, industriella tillämpningar och biologiskt nedbrytbarhet av AAS.
02 Strukturella egenskaper
De icke-polära hydrofoba fettsyrakedjorna av AA kan variera i struktur, kedjelängd och antal.Den strukturella mångfalden och den höga ytaktiviteten hos AA: er förklarar deras breda sammansättningsdiversitet och fysikalisk -kemiska och biologiska egenskaper. Huvudgrupperna för AA: er består av aminosyror eller peptider. Skillnaderna i huvudgrupperna bestämmer adsorption, aggregering och biologisk aktivitet hos dessa ytaktiva ämnen. De funktionella grupperna i huvudgruppen bestämmer sedan typen av AAS, inklusive katjoniska, anjoniska, nonjoniska och amfoteriska. Kombinationen av hydrofila aminosyror och hydrofoba långkedjiga delar bildar en amfifil struktur som gör molekylen mycket ytlig aktiv. Dessutom hjälper närvaron av asymmetriska kolatomer i molekylen att bilda chirala molekyler.
03 Kemisk sammansättning
Alla peptider och polypeptider är polymerisationsprodukterna för dessa nästan 20 a-proteinogena a-aminosyror. Alla 20 a-aminosyror innehåller en karboxylsyrafunktionell grupp (-COOH) och en amino-funktionell grupp (-NH2), båda fäst vid samma tetraedrala a-kolatom. Aminosyror skiljer sig från varandra av de olika R-grupperna fästa vid a-kolen (med undantag för lycin, där R-gruppen är väte.) R-grupperna kan skilja sig i struktur, storlek och laddning (surhet, alkalinitet). Dessa skillnader bestämmer också lösligheten för aminosyror i vatten.
Aminosyror är kirala (med undantag för glycin) och är optiskt aktiva av naturen eftersom de har fyra olika substituenter kopplade till alfa -kolet. Aminosyror har två möjliga konformationer; De är icke överlappande spegelbilder av varandra, trots att antalet L-stereoisomerer är betydligt högre. R-gruppen som finns i vissa aminosyror (fenylalanin, tyrosin och tryptofan) är aryl, vilket leder till en maximal UV-absorption vid 280 nm. Den sura a-COOH och de grundläggande a-NH2 i aminosyror kan jonisering, och båda stereoisomerer, oavsett vad de är, konstruerar joniseringsjämvikten som visas nedan.
R-cooh ↔r-coo-+ h+
R-nh3+↔R-NH2+ h+
Såsom visas i joniseringsjämvikten ovan innehåller aminosyror minst två svagt sura grupper; Karboxylgruppen är emellertid mycket surare jämfört med den protonerade aminogruppen. pH 7,4, karboxylgruppen avprotoneras medan aminogruppen protoneras. Aminosyror med icke-joniserbara R-grupper är elektriskt neutrala vid detta pH och bildar zwitterion.
04 Klassificering
AAS kan klassificeras enligt fyra kriterier, som beskrivs nedan i sin tur.
4.1 Enligt ursprunget
| Enligt ursprunget kan AAS delas upp i två kategorier enligt följande. ① Naturlig kategori Vissa naturligt förekommande föreningar som innehåller aminosyror har också förmågan att minska yt-/gränsytespänningen, och vissa överskrider till och med effekten av glykolipider. Dessa AA: er är också kända som lipopeptider. Lipopeptider är föreningar med låg molekylvikt, vanligtvis producerade av Bacillus -arter.
Sådana AA: er är vidare uppdelade i tre underklasser:Surfactin, Iturin och Fengycin.
|
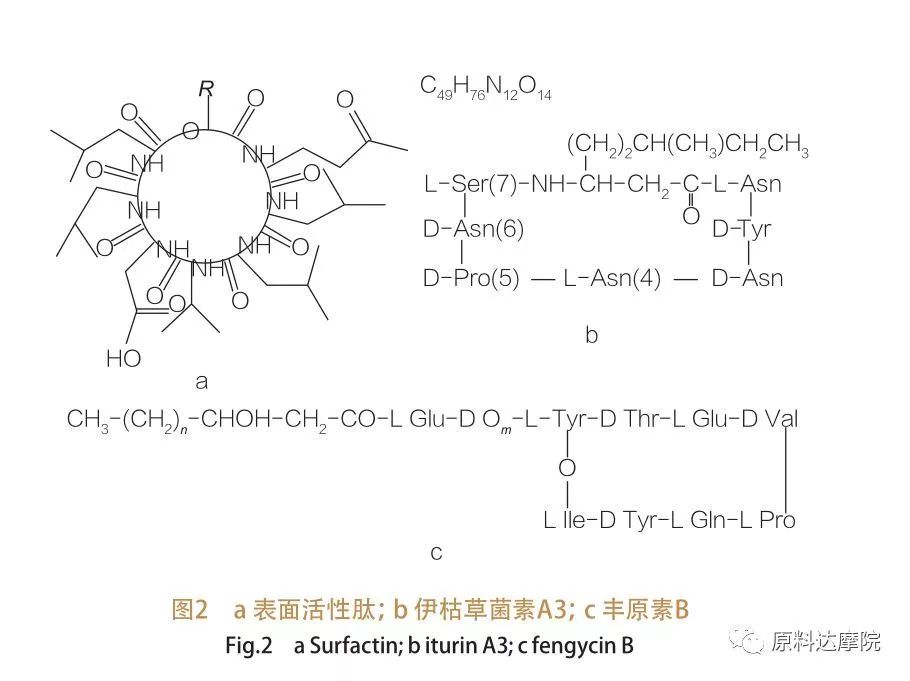
| Familjen av ytaktiva peptider omfattar heptapeptidvarianter av olika ämnen,såsom visas i figur 2A, där en C12-C16 omättad p-hydroxi-fettsyrakedja är kopplad till peptiden. Den ytaktiva peptiden är en makrocyklisk lakton där ringen är stängd genom katalys mellan C-terminalen av p-hydroxifettsyran och peptiden. I underklassen av Iturin finns det sex huvudvarianter, nämligen Iturin A och C, Mycosubtilin och Bacillomycin D, F och L.I alla fall är heptapeptiderna kopplade till C14-C17-kedjorna av ß-amino-fettsyror (kedjorna kan vara olika). När det gäller ekurimycins kan aminogruppen vid p-positionen bilda en amidbindning med C-terminalen och därmed bilda en makrocyklisk laktamstruktur.
Underklassen fengycin innehåller fengycin A och B, som också kallas plipastatin när Tyr9 är D-konfigurerad.Decapeptiden är kopplad till en C14 -C18 mättad eller omättad p -hydroxi -fettsyrakedja. Strukturellt sett är plipastatin också en makrocyklisk lakton, som innehåller en Tyr-sidokedja i position 3 i peptidsekvensen och bildar en esterbindning med den C-terminala resten, och bildar således en intern ringstruktur (som är fallet för många pseudomonas lipopeptider).
② Syntetisk kategori AAS kan också syntetiseras genom att använda någon av de sura, grundläggande och neutrala aminosyrorna. Vanliga aminosyror som används för syntes av AA är glutaminsyra, serin, prolin, aspartinsyra, glycin, arginin, alanin, leucin och proteinhydrolysat. Denna underklass av ytaktiva medel kan framställas med kemiska, enzymatiska och kemoenzymatiska metoder; För produktion av AAS är emellertid kemisk syntes mer ekonomiskt genomförbar. Vanliga exempel inkluderar N-lauroyl-L-glutaminsyra och N-palmitoyl-L-glutaminsyra.
|
4.2 Baserat på alifatiska kedjesubstituenter
Baserat på de alifatiska kedjesubstituenterna kan aminosyrabaserade ytaktiva medel delas upp i två typer.
Enligt substituentens position
| ①n-substituerad AAS I N-substituerade föreningar ersätts en aminogrupp av en lipofil grupp eller en karboxylgrupp, vilket resulterar i en förlust av basicitet. Det enklaste exemplet på N-substituerade AA: er är A-acyl aminosyror, som i huvudsak är anjoniska ytaktiva medel. N-substituerade AA: er har en amidbindning fäst mellan de hydrofoba och hydrofila delarna. Amidbindningen har förmågan att bilda en vätebindning, vilket underlättar nedbrytningen av detta ytaktiva medel i en sur miljö, vilket gör det biologiskt nedbrytbart.
②C-substituerad AAS I C-substituerade föreningar sker substitutionen vid karboxylgruppen (via en amid- eller esterbindning). Typiska C-substituerade föreningar (t.ex. estrar eller amider) är i huvudsak katjoniska ytaktiva medel.
③n- och c-substituerad AAS I denna typ av ytaktivt medel är både amino- och karboxylgrupperna den hydrofila delen. Denna typ är i huvudsak ett amfotiskt ytaktivt medel. |
4.3 Enligt antalet hydrofoba svansar
Baserat på antalet huvudgrupper och hydrofoba svansar kan AAS delas upp i fyra grupper. Rakkedja AAS, Gemini (dimer) typ AAS, glycerolipid typ AAS och bicefalisk amfifil (BOLA) typ AAS. Rakkedja-ytaktiva ämnen är ytaktiva medel som består av aminosyror med endast en hydrofob svans (figur 3). Gemini -typ AAS har två aminosyraspolära huvudgrupper och två hydrofoba svansar per molekyl (figur 4). I denna typ av struktur är de två raka kedjorna AAS kopplade samman av en distans och kallas därför också dimerer. I Glycerolipid -typ AAS är å andra sidan de två hydrofoba svansarna fästa vid samma aminosyradrupp. Dessa ytaktiva medel kan betraktas som analoger av monoglycerider, diglycerider och fosfolipider, medan två aminosyrhuvudgrupper är i BOLA-typ AAS kopplade av en hydrofob svans.
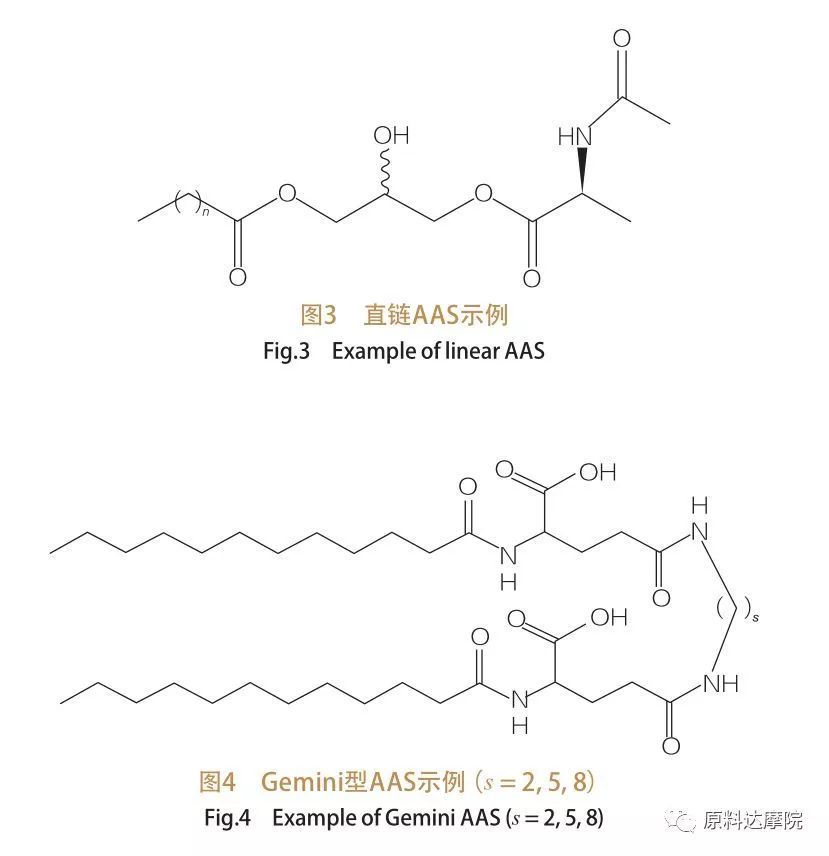
4.4 Enligt typen av huvudgrupp
①Cationic AAS
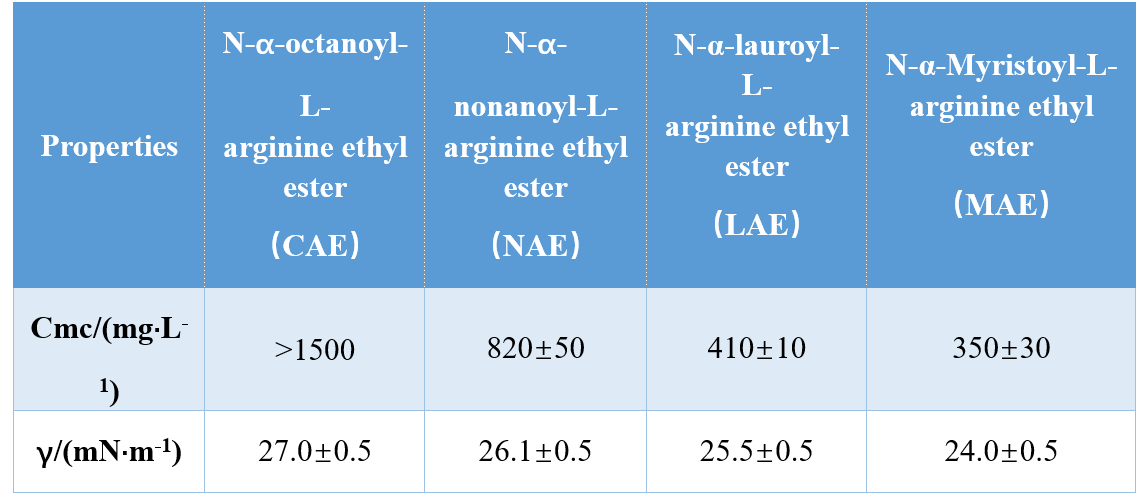
Huvudgruppen för denna typ av ytaktivt medel har en positiv laddning. Det tidigaste katjoniska AAS är etylscoylarginat, som är ett pyrrolidonkarboxylat. De unika och mångfaldiga egenskaperna hos detta ytaktiva medel gör det användbart i desinfektionsmedel, antimikrobiella medel, antistatiska medel, hårbalsam, samt att vara mild mot ögon och hud och lätt biologiskt nedbrytbara. Singare och Mhatre syntetiserade argininbaserade katjoniska AA: er och utvärderade deras fysikalisk-kemiska egenskaper. I denna studie hävdade de höga utbyten av de produkter som erhölls med hjälp av Schotten-Baumann-reaktionsförhållanden. Med ökande alkylkedjelängd och hydrofobicitet befanns ytaktiviteten hos det ytaktiva ämnet öka och den kritiska micellkoncentrationen (CMC) för att minska. En annan är det kvartära acylproteinet, som vanligtvis används som balsam i hårvårdsprodukter.
②anionisk AAS
I anjoniska ytaktiva ämnen har den polära huvudgruppen för det ytaktiva ämnet en negativ laddning. Sarkosin (CH3 -NH -CH 2 -COOH, N -metylglycin), en aminosyra som vanligtvis finns i havsborre och havsstjärnor, är kemiskt relaterat till glycin (NH2 -CH 2 -COOH,), en basisk aminosyra som finns i däggdjursceller. -COOH,) är kemiskt relaterat till glycin, som är en grundläggande aminosyra som finns i däggdjursceller. Laurinsyra, tetradekansyra, oljesyra och deras halogenider och estrar används vanligtvis för att syntetisera sarkosinatens ytaktiva medel. Sarkosinater är i sig milda och används därför vanligtvis i munvatten, schampon, sprayskumskum, solskyddsmedel, hudrengöringsmedel och andra kosmetiska produkter.
Andra kommersiellt tillgängliga anjoniska AA: er inkluderar Amisoft CS-22 och AmilitegCK-12, som är handelsnamn för natrium-N-Cocoyl-L-glutamat och kalium N-kookoylglycinat. Amilite används ofta som ett skummande medel, tvättmedel, solubilisator, emulgator och dispergeringsmedel, och har många applikationer inom kosmetika, såsom schampon, badsålor, kroppstvätt, tandkräm, ansiktsrengöringsmedel, rengöring av tvålar, kontaktlinsstädare och hushållens ytaktiva ämnen. Amisoft används som en mild hud- och hårrengöring, främst i ansikts- och kroppsrengöringsmedel, blockerar syntetiska tvättmedel, kroppsvårdsprodukter, schampon och andra hudvårdsprodukter.
③zwitterionic eller amfoteriska AAS
Amfoteriska ytaktiva medel innehåller både sura och grundläggande platser och kan därför ändra sin laddning genom att ändra pH -värdet. In alkaline media they behave like anionic surfactants, while in acidic environments they behave like cationic surfactants and in neutral media like amphoteric surfactants. Lauryllysin (LL) och alkoxi (2-hydroxipropyl) arginin är de enda kända amfoteriska ytaktiva medel som är baserade på aminosyror. LL är en kondensationsprodukt av lysin och laurinsyra. På grund av dess amfoteriska struktur är LL olöslig i nästan alla typer av lösningsmedel, med undantag för mycket alkaliska eller sura lösningsmedel. As an organic powder, LL has excellent adhesion to hydrophilic surfaces and a low coefficient of friction, giving this surfactant excellent lubricating ability. LL används ofta i hudkrämer och hårbalsam och används också som smörjmedel.
④nonionisk aas
Nonjoniska ytaktiva medel kännetecknas av polära huvudgrupper utan formella laddningar. Åtta nya etoxylerade nonjoniska ytaktiva medel framställdes av Al-Sabagh et al. från oljlösliga a-aminosyror. I denna process föreställdes först L-fenylalanin (LEP) och L-leucin med hexadecanol, följt av amidering med palmitinsyra för att ge två amider och två estrar av a-aminosyror. Amiderna och estrarna genomgick sedan kondensationsreaktioner med etenoxid för att framställa tre fenylalaninderivat med olika antal polyoxietylenenheter (40, 60 och 100). Dessa nonjoniska AA: er visade sig ha god tvättstugor och skummande egenskaper.
05 Syntes
5.1 Grundläggande syntetisk väg
I AAS kan hydrofoba grupper fästas på amin- eller karboxylsyror eller genom sidokedjorna av aminosyror. Baserat på detta finns fyra grundläggande syntetiska rutter tillgängliga, som visas i figur 5.
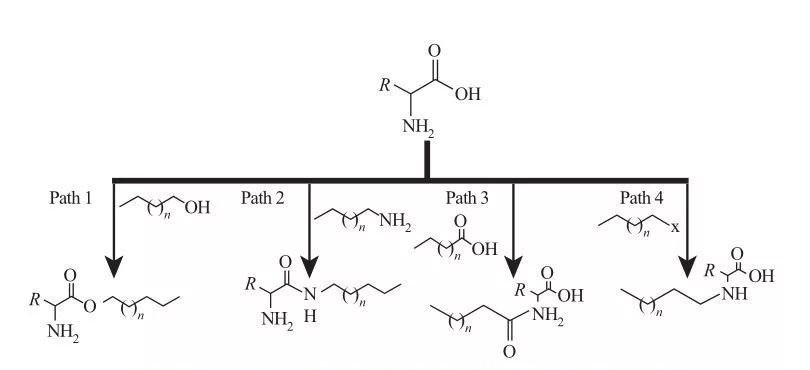
Fig.5 Grundläggande syntesvägar för aminosyrasbaserade ytaktiva medel
| Väg 1. Amfifiliska esteraminer produceras genom förestringsreaktioner, i vilket fall den ytaktiva syntesen vanligtvis uppnås genom återflödande fetthalmar och aminosyror i närvaro av ett dehydratiseringsmedel och en sur katalysator. I vissa reaktioner fungerar svavelsyran som både en katalysator och ett dehydratiseringsmedel.
Väg 2. Aktiverade aminosyror reagerar med alkylaminer för att bilda amidbindningar, vilket resulterar i syntesen av amfifila amidoaminer.
Väg 3. Amidosyror syntetiseras genom att reagera amingrupperna av aminosyror med amidosyror.
Väg 4. Långkedjiga alkylaminosyror syntetiserades genom reaktionen från amingrupper med haloalkaner. |
5.2 Framsteg inom syntes och produktion
5.2.1 Syntes av enkedjans aminosyra/peptids-ytaktiva medel
N-acyl- eller O-acyl aminosyror eller peptider kan syntetiseras genom enzymkatalyserad acylering av amin- eller hydroxylgrupper med fettsyror. The earliest report on the solvent-free lipase-catalyzed synthesis of amino acid amide or methyl ester derivatives used Candida antarctica, with yields ranging from 25% to 90% depending on the target amino acid. Metyletylketon har också använts som lösningsmedel i vissa reaktioner. Vonderhagen et al. also described lipase and protease-catalyzed N-acylation reactions of amino acids, protein hydrolysates and/or their derivatives using a mixture of water and organic solvents (eg, dimethylformamide/water) and methyl butyl ketone.
Under de första dagarna var huvudproblemet med enzymkatalyserad syntes av AAS de låga utbytena. Enligt ValiveTy et al. Utbytet av n-tetradekanoylaminosyrorivat var endast 2% -10% även efter att ha använt olika lipaser och inkubering vid 70 ° C under många dagar. Montet et al. Möter också problem med det låga utbytet av aminosyror i syntesen av N-acyl-lysin med användning av fettsyror och vegetabiliska oljor. Enligt dem var produktens maximala utbyte 19% under lösningsmedelsfria förhållanden och med användning av organiska lösningsmedel. Samma problem uppstod av ValiveTy et al. i syntesen av N-CBZ-L-lysin eller N-CBZ-lysinmetylesterderivat.
I denna studie hävdade de att utbytet av 3-O-tetradekanoyl-L-serin var 80% vid användning av N-skyddat serin som ett substrat och novozyme 435 som en katalysator i en smält lösningsmedelsfri miljö. Nagao och Kito studerade O-acylering av L-serin, L-homoserin, L-trreonin och L-tyrosin (låt) när man använde lipas resultatet av reaktionen (lipas erhölls av candida cylindracea och rhizopus delemar i vattenhaltigt buffert medium) och rapporterade att utbytet av acylation av l-H-H-HOMERINE var någon som är en annan buffert medium) och rapporterade att utbytet av acylering av L-H-HOMOERINE VARA RHIZOPUS DELEMAR i vattenhaltigt buffert Medium) och rapporterade att utbytet av acylation av L-H-HOMERINE var någon ACHATION ACHATION MÅL NO-ACHEAL MEAL MEA ACAL MED MÅR NO ACHE ACAL MED MÅR NO ACHE ACHE MEA L-treonin och låt inträffade.
Många forskare har stött användningen av billiga och lätt tillgängliga underlag för syntes av kostnadseffektiva AAS. Soo et al. hävdade att framställningen av palmoljebaserade ytaktiva medel fungerar bäst med immobiliserat lipoenzym. De noterade att utbytet av produkterna skulle vara bättre trots den tidskrävande reaktionen (6 dagar). Gerova et al. undersökte syntesen och ytaktiviteten för kiral N-palmitoyl AAS baserat på metionin, prolin, leucin, treonin, fenylalanin och fenylglycin i en cyklisk/racemisk blandning. Pang och CHU beskrev syntesen av aminosyrasbaserade monomerer och dikarboxylsyrabaserade monomerer i lösning En serie funktionella och biologiskt nedbrytbara aminosyrasbaserade polyamidestrar syntetiserades genom samkondensationsreaktioner i lösning.
Cantaeuzene och Guerreiro rapporterade förestring av karboxylsyragrupper av Boc-ala-OH och BOC-ASP-OH med långkedjiga alifatiska alkoholer och dioler, med diklormetan som lösningsmedel och agaros 4B (Sepharose 4B) som katalysator. I denna studie gav reaktionen av Boc-Ala-OH med fett alkoholer upp till 16 kolhydrater goda utbyten (51%), medan Boc-ASP-OH 6 och 12 kol var bättre, med en motsvarande utbyte på 63% [64]. 99,9%) i utbyten från 58%till 76%, som syntetiserades genom bildning av amidbindningar med olika långkedjiga alkylaminer eller esterbindningar med fettalkoholer med CBZ-Arg-OME, där papain fungerade som en katalysator.
5.2.2 Syntes av Gemini-baserade aminosyror/peptids-ytaktiva ämnen
Aminosyras-baserade Gemini-ytaktiva ämnen består av två raka kedjor AAS-molekyler kopplade head-to-head till varandra av en distansgrupp. Det finns två möjliga scheman för den kemoenzymatiska syntesen av aminosyras-baserade ytaktiva medel (figur 6 och 7). I figur 6 reageras 2 aminosyrorivat med föreningen som en distansgrupp och sedan införs 2 hydrofoba grupper. I figur 7 är de två raka kedjestrukturerna direkt kopplade samman av en bifunktionell distansgrupp.
Den tidigaste utvecklingen av enzymkatalyserad syntes av Gemini lipoaminosyror var banbrytande av ValiveTy et al. Yoshimura et al. undersökte syntesen, adsorptionen och aggregeringen av ett aminosyras-baserad gemini-ytaktivt medel baserat på cystin och N-alkylbromid. De syntetiserade ytaktiva medel jämfördes med motsvarande monomera ytaktiva medel. Faustino et al. beskrev syntesen av anjonisk urea-baserad monomera AAS baserat på L-cystin, D-cystin, DL-cystin, L-cystein, L-metionin och L-sulfoalanin och deras par av gemini med hjälp av konduktivitet, jämviktsytans spänning och stabilitetsfluorescenskarakterisering av dem. Det visades att CMC -värdet för Gemini var lägre genom att jämföra monomer och gemini.
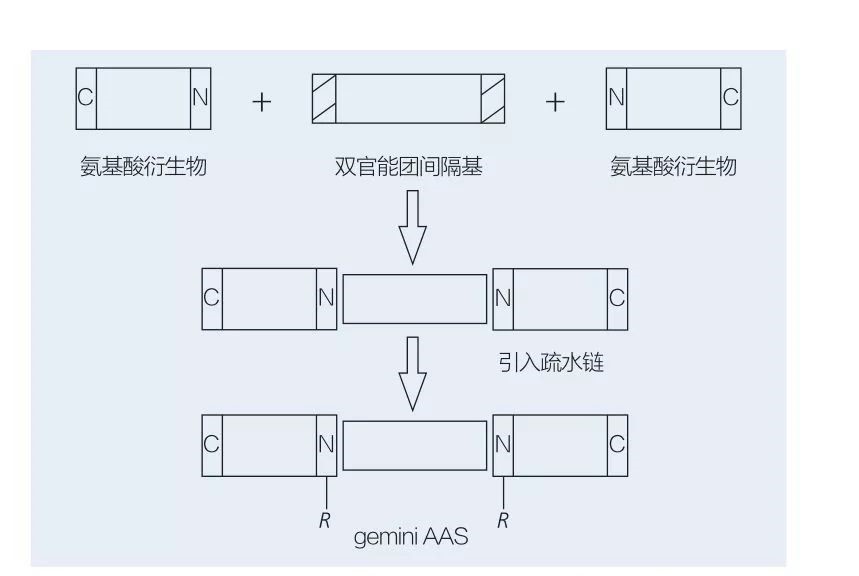
Fig.6 Syntes av Gemini AAS med användning av AA -derivat och distans, följt av införande av den hydrofoba gruppen
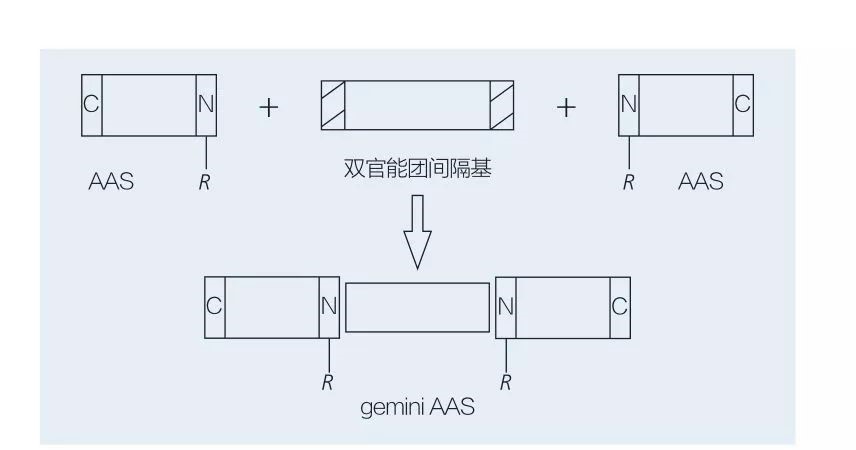
Fig.7 Syntes av Gemini AAS med hjälp av bifunktionell distans och AAS
5.2.3 Syntes av glycerolipid aminosyran/peptidsytaktiva medel
Glycerolipid aminosyran/peptids-ytaktiva medel är en ny klass av lipidaminosyror som är strukturella analoger av glycerolmono- (eller di-) estrar och fosfolipider, på grund av deras struktur av en eller två fettkedjor med en aminosyra kopplad till glycerol-ryggraden med en ester. Syntesen av dessa ytaktiva medel börjar med framställning av glycerolestrar av aminosyror vid förhöjda temperaturer och i närvaro av en sur katalysator (t.ex. BF 3). Enzymkatalyserad syntes (med användning av hydrolaser, proteaser och lipaser som katalysatorer) är också ett bra alternativ (figur 8).
Den enzymkatalyserade syntesen av dilaurylerade argininglycerider-konjugat med användning av papain har rapporterats. Syntes av diacylglycerolesterkonjugat från acetylarginin och utvärdering av deras fysikalisk -kemiska egenskaper har också rapporterats.
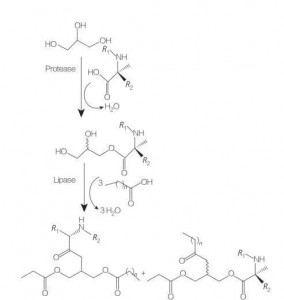
Fig.8 Syntes av mono och diacylglycerolaminosyrakonjugat
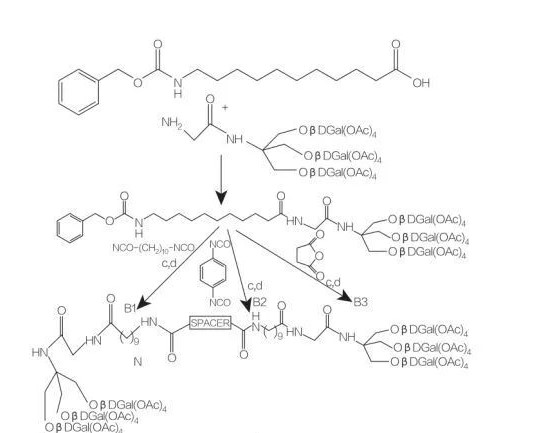
distans: nh- (ch2)10-NH: Compoundb1
distans: NH-C6H4-NH: Compoundb2
distans: ch2-Ch2: compoundb3
Fig.9 Syntes av symmetriska amfifiler härrörande från Tris (hydroximetyl) Aminometan
5.2.4 Syntes av bola-baserade aminosyror/peptids-ytaktiva medel
Aminosyras amfifiler av bola-typ innehåller 2 aminosyror som är kopplade till samma hydrofoba kedja. Franceschi et al. beskrev syntesen av amfifiler av bola-typ med 2 aminosyror (D- eller L-alanin eller L-histidin) och 1 alkylkedja med olika längder och undersökte deras ytaktivitet. De diskuterar syntesen och aggregeringen av nya amfifiler av bola-typ med en aminosyrfraktion (med användning av antingen en ovanlig ß-aminosyra eller en alkohol) och en C12-C20 spacergrupp. De ovanliga ß-aminosyrorna som används kan vara en sockeraminoacid, ett azidotymin (AZT) -ledda aminosyra, en norbornen aminosyra och en aminokohol härrörande från AZT (figur 9). Syntesen av symmetriska amfifiler av bola-typ härrörande från Tris (hydroximetyl) aminometan (Tris) (figur 9).
06 Fysikalisk -kemiska egenskaper
Det är välkänt att aminosyrasbaserade ytaktiva medel (AAS) är olika och mångsidiga till sin natur och har god användbarhet i många tillämpningar såsom god solubilisering, goda emulgeringsegenskaper, hög effektivitet, hög ytaktivitet och god motstånd mot hårt vatten (kalciumjontolerans).
Baserat på de ytaktiva egenskaperna hos aminosyror (t.ex. ytspänning, CMC, fasbeteende och Krafft -temperatur) nåddes följande slutsatser efter omfattande studier - ytaktiviteten för AAS är överlägsen den för dess konventionella ytaktiva motsvarighet.
6.1 Kritisk micellkoncentration (CMC)
Kritisk micellkoncentration är en av de viktiga parametrarna för ytaktiva medel och styr många ytaktiva egenskaper såsom solubilisering, celllys och dess interaktion med biofilmer, etc. I allmänhet, vilket ökar kedjelängden för kolvätesvansen (ökande hydrofobicitet) leder till en minskning av CMC -värdet för den ytaktiva lösningen, vilket ökar dess ytaktivitet. Ytaktiva medel baserade på aminosyror har vanligtvis lägre CMC -värden jämfört med konventionella ytaktiva medel.
Yoshimura et al. undersökte CMC för cystein-härledda aminosyrasbaserade gemini-ytaktiva ämnen och visade att CMC minskade när kolkedjelängden i den hydrofoba kedjan ökades från 10 till 12. Ytterligare ökning av kolkedjelängden till 14 resulterade i en ökning av CMC, vilket bekräftade att långkedjig tandkamini-ytbehandling har en lägre tendens till 14 resulterade i en ökning av CMC, vilket bekräftade att långkedjig tandkamini-ytbehandling har en lägre tendens till 14 resulterade i en ökning av CMC, vilket bekräftade att långkedjig tandkamini-ytbehandling har en lägre tendens till 14 resulterade i en ökning av CMC, vilket bekräftade att långkedjiga tandkamini-ytbehandling har en lägre tendens.
Faustino et al. rapporterade bildandet av blandade miceller i vattenhaltiga lösningar av anjoniska gemini -ytaktiva medel baserade på cystin. Gemini -ytaktiva medel jämfördes också med motsvarande konventionella monomera ytaktiva medel (C 8 Cys). CMC-värdena för lipid-surfaktantblandningar rapporterades vara lägre än de för rena ytaktiva ämnen. Gemini-ytaktiva ämnen och 1,2-diheptanoyl-SN-glyceryl-3-fosfokolin, en vattenlöslig, micellbildande fosfolipid, hade CMC i millimolär nivå.
Shrestha och Aramaki undersökte bildningen av viskoelastiska maskliknande miceller i vattenhaltiga lösningar av blandad aminosyrasbaserad anjonisk-nonionisk ytaktiva medel i frånvaro av blandningssalter. I denna studie befanns N-Dodecyl-glutamat ha en högre Krafft-temperatur; Men när neutraliserade med den grundläggande aminosyran L-lysin genererade den miceller och lösningen började uppträda som en Newtonian-vätska vid 25 ° C.
6.2 Bra vattenlöslighet
Den goda vattenlösligheten för AAS beror på närvaron av ytterligare CO-NH-bindningar. Detta gör AAS mer biologiskt nedbrytbart och miljövänligt än motsvarande konventionella ytaktiva ämnen. Vattenlösligheten för N-acyl-L-glutaminsyra är ännu bättre på grund av dess 2 karboxylgrupper. Vattenlösligheten för CN (Ca) 2 är också bra eftersom det finns 2 joniska arginingrupper i 1 molekyl, vilket resulterar i mer effektiv adsorption och diffusion vid cellgränssnittet och till och med effektiv bakteriell hämning vid lägre koncentrationer.
6.3 Krafttemperatur och Krafft Point
Krafttemperatur kan förstås som det specifika löslighetsbeteendet hos ytaktiva medel vars löslighet ökar kraftigt över en viss temperatur. Joniska ytaktiva medel har en tendens att generera fasta hydrater, som kan fälla ut ur vatten. Vid en viss temperatur (den så kallade Kraft-temperaturen) observeras vanligtvis en dramatisk och diskontinuerlig ökning av ytaktiva ämnen. Kraftpunkten för ett joniskt ytaktivt medel är dess KRAFFT -temperatur vid CMC.
Denna löslighetskarakteristik ses vanligtvis för joniska ytaktiva medel och kan förklaras på följande sätt: lösligheten för den ytaktiva fria monomeren är begränsad under Krafft -temperaturen tills Kraft -punkten har uppnåtts, där dess löslighet gradvis ökar på grund av micellbildning. För att säkerställa fullständig löslighet är det nödvändigt att framställa ytaktiva formuleringar vid temperaturer ovanför Kraft -punkten.
Krafttemperaturen hos AAS har studerats och jämförts med den för konventionella syntetiska ytaktiva medel. Shrestha och Aramaki studerade Kraft-temperaturen för argininbaserad AAS och fann att den kritiska micellkoncentrationen uppvisade aggregeringsbeteende i form av pre-miceller över 2-5 × 10-6 mol-l -1 följt av normal micelle (Oh et al. och diskuterade förhållandet mellan deras KRAFFT -temperatur och aminosyrarester.
I experimenten konstaterades det att KRAFFT-temperaturen för N-hexadecanoyl AAS ökade med minskande storlek på aminosyrarester (fenylalanin var ett undantag), medan värmen av löslighet (värmeupptag) ökade med minskande storlek på aminosyrarester (med undantag av glycin och fenylalanin). Det drogs slutsatsen att i både alanin- och fenylalaninsystem är DL-interaktionen starkare än LL-interaktionen i den fasta formen av N-hexadecanoyl AAS-salt.
Brito et al. bestämde Krafttemperaturen för tre serier av nya aminosyrasbaserade ytaktiva medel med användning av differentiell skanningsmikrokalorimetri och fann att förändring av trifluoroacetatjon till jodidjon resulterade i en signifikant ökning av KRAFFT-temperaturen (cirka 6 ° C), från 47 ° C till 53 ° C. Närvaron av cis-dubbla bindningar och omättningen som finns i de långkedjiga Ser-derivaten ledde till en signifikant minskning av Kraft-temperaturen. N-Dodecyl-glutamat rapporterades ha en högre Kraft-temperatur. Neutralisering med den grundläggande aminosyran L-lysin resulterade emellertid i bildningen av miceller i lösning som uppförde sig som Newtonian-vätskor vid 25 ° C.
6.4 Ytspänning
Ytspänningen hos ytaktiva ämnen är relaterad till kedjelängden på den hydrofoba delen. Zhang et al. bestämde ytspänningen för natriumkokoylglycinat med Wilhelmy -plattmetoden (25 ± 0,2) ° C och bestämde ytspänningsvärdet vid CMC som 33 mn -M -1, CMC som 0,21 mmol -L -1. Yoshimura et al. bestämde ytspänningen för 2C N Cys typ aminosyras baserad ytspänning av 2C N Cys-baserade ytaktiva medel. Det visade sig att ytspänningen vid CMC minskade med ökande kedjelängd (tills n = 8), medan trenden vändes för ytaktiva medel med n = 12 eller längre kedjelängder.
Effekten av CAC1 2 på ytspänningen hos dikarboxylerade aminosyrasbaserade ytaktiva medel har också studerats. I dessa studier sattes CAC1 2 till vattenhaltiga lösningar av tre dikarboxylerade aminosyratyps ytaktiva medel (C12 Malna 2, C12 Aspna 2 och C12 Gluna 2). Platåvärdena efter CMC jämfördes och det konstaterades att ytspänningen minskade vid mycket låga CAC12 -koncentrationer. Detta beror på effekten av kalciumjoner på arrangemanget av ytaktivt medel vid gasvattengränssnittet. Ytspänningarna på salterna av N-dodecylaminomalonat och N-dodecylaspartat, å andra sidan, var också nästan konstant upp till 10 mmol-L -1 CAC1 2-koncentration. Över 10 mmol -l -1 ökar ytspänningen kraftigt på grund av bildandet av en utfällning av kalciumsaltet hos det ytaktiva ämnet. För diskodiumsaltet av N-Dodecyl-glutamat resulterade måttligt tillsats av CAC1 2 i en signifikant minskning av ytspänningen, medan fortsatt ökning av CAC12-koncentrationen inte längre orsakade signifikanta förändringar.
För att bestämma adsorptionskinetiken för Gemini-typ AAS vid gas-vattengränssnittet bestämdes den dynamiska ytspänningen med användning av den maximala bubbeltrycksmetoden. Resultaten visade att under den längsta testtiden förändrades inte 2C 12 Cys dynamiska ytspänning. Minskningen av den dynamiska ytspänningen beror endast på koncentrationen, längden på de hydrofoba svansarna och antalet hydrofoba svansar. Ökande koncentration av ytaktivt medel, minskande kedjelängd såväl som antalet kedjor resulterade i ett snabbare förfall. Resultaten erhållna för högre koncentrationer av C N Cys (n = 8 till 12) visade sig vara mycket nära y CMC uppmätt med Wilhelmy -metoden.
I en annan studie bestämdes de dynamiska ytspänningarna av natrium dilaurylcystin (SDLC) och natriumdecamino -cystin med metoden Wilhelmy -plattan, och dessutom bestämdes jämviktsytorna för deras vattenhaltiga lösningar med droppvolymmetoden. Reaktionen av disulfidbindningar undersöktes också med andra metoder. Tillsatsen av Mercaptoethanol till 0,1 mmol -L -1SDLC -lösning ledde till en snabb ökning av ytspänningen från 34 mn -M -1 till 53 mn -M -1. Eftersom NaClo kan oxidera disulfidbindningarna för SDLC till sulfonsyrogrupper observerades inga aggregat när NaClO (5 mmol -L -1) sattes till 0,1 mmol -L -1 SDLC -lösning. Överföringselektronmikroskopi och dynamiska ljusspridningsresultat visade att inga aggregat bildades i lösningen. Ytspänningen för SDLC visade sig öka från 34 mn -M -1 till 60 mn -M -1 under en period av 20 minuter.
6.5 Binära ytinteraktioner
Inom biovetenskapen har ett antal grupper studerat vibrationsegenskaperna för blandningar av katjoniska AA: er (diacylglycerolargininbaserade ytaktiva medel) och fosfolipider vid gasvattengränssnittet, slutligen drog slutsatsen att denna icke-ideala egenskap orsakar förekomsten av elektrostatiska interaktion.
6.6 Aggregeringsegenskaper
Dynamisk ljusspridning används vanligtvis för att bestämma aggregeringsegenskaperna för aminosyrasbaserade monomerer och gemini-ytaktiva medel vid koncentrationer över CMC, vilket ger en uppenbar hydrodynamisk diameter DH (= 2R H). Aggregaten som bildas av C N Cys och 2CN Cys är relativt stora och har en vidskalig distribution jämfört med andra ytaktiva medel. Alla ytaktiva ämnen förutom 2C 12 Cys bildar vanligtvis aggregat på cirka 10 nm. Micellstorlekar av Tvelaktiva Gemini är betydligt större än för deras monomera motsvarigheter. En ökning av kolvätekedjelängden leder också till en ökning av micellstorleken. Ohta et al. beskrev aggregeringsegenskaperna hos tre olika stereoisomerer hos N-dodecyl-fenyl-alanyl-fenyl-alanin-tetrametylammonium i vattenlösning och visade att diastereoisomererna har samma kritiska aggregeringskoncentration i vattenlösning. Iwahashi et al. investigated by circular dichroism, NMR and vapor pressure osmometry the The formation of chiral aggregates of N-dodecanoyl-L-glutamic acid, N-dodecanoyl-L-valine and their methyl esters in different solvents (such as tetrahydrofuran, acetonitrile, 1,4-dioxane and 1,2-dichloroethane) with rotational properties was investigated by circular Dikroism, NMR och ångtryck osmometri.
6.7 Gränssnitt adsorption
Interyte-adsorptionen av aminosyrabaserade ytaktiva medel och dess jämförelse med dess konventionella motsvarighet är också en av forskningsriktningarna. Till exempel undersöktes de gränsyte adsorptionsegenskaperna hos dodecylestrar av aromatiska aminosyror erhållna från LET och LEP. Resultaten visade att LET och LEP uppvisade lägre gränssnittsområden vid gas-vätskan gränssnittet respektive vid vatten/hexangränssnittet.
Bordes et al. undersökte lösningsbeteendet och adsorptionen vid gas-vattengränssnittet för tre dikarboxylerade aminosyratrensande ämnen, DISODIUM-salterna för dodekylglutamat, dodekylaspartat och aminomalonat (med 3, 2 och 1 kolatomer mellan de två karboxylgrupperna). Enligt denna rapport var CMC för de dikarboxylerade ytaktiva ämnena 4-5 gånger högre än för det monokarboxylerade dodecylglycinsaltet. Detta tillskrivs bildandet av vätebindningar mellan de dikarboxylerade ytaktiva medel och angränsande molekyler genom amidgrupperna däri.
6.8 Fasbeteende
Isotropiska diskontinuerliga kubiska faser observeras för ytaktiva medel vid mycket höga koncentrationer. Surfaktiva molekyler med mycket stora huvudgrupper tenderar att bilda aggregat med mindre positiv krökning. Marques et al. studied the phase behavior of the 12Lys12/12Ser and 8Lys8/16Ser systems (see Figure 10), and the results showed that the 12Lys12/12Ser system has a phase separation zone between the micellar and vesicular solution regions, while the 8Lys8/16Ser system The 8Lys8/16Ser system shows a continuous transition (elongated micellar phase region between the small micellar phase region and the vesicle phase region). Det bör noteras att för vesikelregionen i 12LYS12/12SER -systemet är vesiklar alltid samexisterande med miceller, medan vesikelregionen i 8LYS8/16SER -systemet bara har vesiklar.
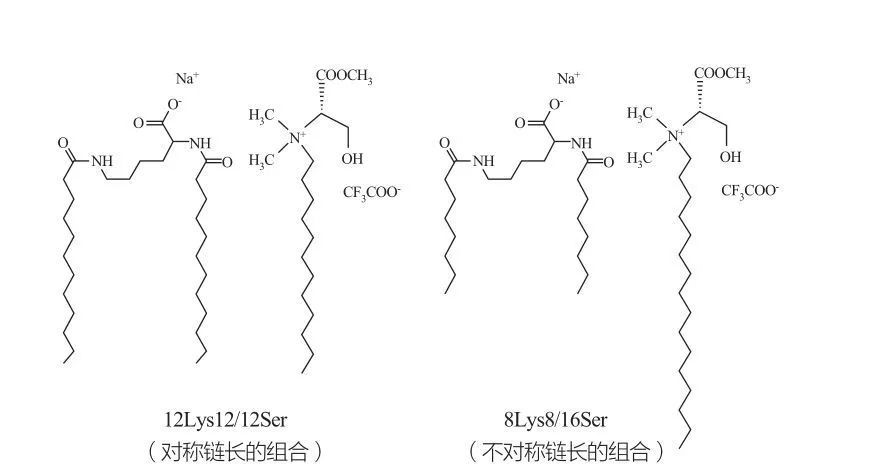
Katanjoniska blandningar av de lysin- och serinbaserade ytaktiva ämnena: Symmetriska 12LYS12/12SER-par (vänster) och asymmetriska 8lys8/16Ser-par (höger)
6.9 Emulgeringsförmåga
Kouchi et al. undersökte emulgeringsförmågan, gränsytespänningen, dispersibiliteten och viskositeten hos N- [3-Dodecyl-2-hydroxipropyl] -l-arginin, L-glutamat och andra AA: er. I jämförelse med syntetiska ytaktiva medel (deras konventionella nonjoniska och amfoteriska motsvarigheter) visade resultaten att AAS har starkare emulgeringsförmåga än konventionella ytaktiva medel.
Baczko et al. syntetiserade nya anjoniska aminosyrasurfaktiva medel och undersökte deras lämplighet som kiralorienterade NMR -spektroskopi lösningsmedel. En serie sulfonatbaserade amfifiliska L-Phe- eller L-ALA-derivat med olika hydrofoba svansar (pentyl ~ tetradecyl) syntetiserades genom att reagera aminosyror med O-sulfobensoisk anhydrid. Wu et al. syntetiserade natriumsalter av N-Faty acyl AAS ochundersökte deras emulgeringsförmåga i olje-i-vattenemulsioner, och resultaten visade att dessa ytaktiva medel presterade bättre med etylacetat som oljefas än med N-hexan som oljefasen.
6.10 Framsteg inom syntes och produktion
Hårt vattenmotstånd kan förstås som förmågan hos ytaktiva medel att motstå närvaron av joner såsom kalcium och magnesium i hårt vatten, dvs förmågan att undvika nederbörd i kalciumtvålar. Ytaktiva medel med hög hårt vattenmotstånd är mycket användbara för tvättmedelsformuleringar och personliga vårdprodukter. Hårt vattenbeständighet kan utvärderas genom att beräkna förändringen i ytaktivitetens löslighet och ytaktivitet i närvaro av kalciumjoner.
Ett annat sätt att utvärdera hårt vattenmotstånd är att beräkna procentandelen eller gram ytaktiva medel som krävs för kalciumtvålen bildad från 100 g natrium oleat som ska spridas i vatten. I områden med högt hårt vatten kan höga koncentrationer av kalcium- och magnesiumjoner och mineralinnehåll göra vissa praktiska tillämpningar svåra. Ofta används natriumjonen som motjon av ett syntetiskt anjoniskt ytaktivt medel. Eftersom den tvåtalande kalciumjonen är bunden till båda ytaktiva molekylerna, får det ytaktiva medel att fälla lättare från lösningen vilket gör detergensen mindre trolig.
Studien av AA: s hårda vattenmotstånd visade att syran och hårt vattenmotstånd påverkades starkt av en ytterligare karboxylgrupp, och syran och hårt vattenmotstånd ökade ytterligare med ökningen av avståndsgruppens längd mellan de två karboxylgrupperna. Ordningen av syra och hårt vattenmotstånd var C 12 Glycinat <C 12 aspartat <C 12 glutamat. Jämförelse av den dikarboxylerade amidbindningen och det dikarboxylerade aminosurfaktiva medel, konstaterades att pH -området för det senare var bredare och dess ytaktivitet ökade med tillsats av en lämplig mängd syra. De dikarboxylerade N-alkylaminosyrorna visade kelateringseffekt i närvaro av kalciumjoner, och C 12-aspartat bildade vit gel. C 12 glutamat visade hög ytaktivitet vid hög Ca 2+ -koncentration och förväntas användas vid avsaltning av havsvatten.
6.11 Distersibilitet
Dispersibilitet hänvisar till förmågan hos ett ytaktivt medel att förhindra koalescens och sedimentation av det ytaktiva ämnet i lösningen.Disperibilitet är en viktig egenskap hos ytaktiva ämnen som gör dem lämpliga för användning i tvättmedel, kosmetika och läkemedel.Ett spridningsmedel måste innehålla en ester-, eter-, amid- eller aminobindning mellan den hydrofoba gruppen och den terminala hydrofila gruppen (eller bland de raka kedjan hydrofoba grupper).
I allmänhet är anjoniska ytaktiva medel såsom alkanolamidosulfater och amfoteriska ytaktiva medel såsom amidosulfobetain särskilt effektiva som spridande medel för kalciumtvålar.
Många forskningsinsatser har bestämt spridbarheten hos AAS, där N-Lauroyl-lysin visade sig vara dåligt förenlig med vatten och svåra att använda för kosmetiska formuleringar.I denna serie har N-acyl-substituerade basiska aminosyror utmärkt spridbarhet och används i den kosmetiska industrin för att förbättra formuleringarna.
07 Toxicitet
Konventionella ytaktiva medel, särskilt katjoniska ytaktiva medel, är mycket giftiga för vattenlevande organismer. Deras akut toxicitet beror på fenomenet med adsorptionsjoninteraktion mellan ytaktiva medel vid cellvattengränssnittet. Att minska CMC för ytaktiva medel leder vanligtvis till starkare gränsytesorption av ytaktiva medel, vilket vanligtvis resulterar i deras förhöjda akut toxicitet. En ökning av längden på den hydrofoba kedjan av ytaktiva medel leder också till en ökning av ytaktivtoxicitet.De flesta AA: er är låga eller giftfria för människor och miljön (särskilt för marina organismer) och är lämpliga för användning som matingredienser, läkemedel och kosmetika.Många forskare har visat att surfaktiva medel är skonsamma och icke-irriterande för huden. Argininbaserade ytaktiva medel är kända för att vara mindre giftiga än deras konventionella motsvarigheter.
Brito et al. studerade de fysikalisk-kemiska och toxikologiska egenskaperna hos aminosyrabaserade amfifiler och deras [derivat från tyrosin (Tyr), hydroxyprolin (hyp), serin (Ser) och lysin (Lys)] spontan bildning av katjoniska vesiklar och gav data på deras akut toxicitet till dapnia-magna (IC 50). De syntetiserade katjoniska vesiklar av dodecyltrimetylammoniumbromid (DTAB)/Lys-derivativ och/eller ser-/lys-derivativa blandningar och testade deras ekotoxicitet och hemolytisk potential, vilket visar att alla AAS och deras vesikelinnehållande blandningar var mindre toxiska än den konventionella dikt.
Rosa et al. undersökte bindningen (associering) av DNA till stabil aminosyrasbaserade katjoniska vesiklar. Till skillnad från konventionella katjoniska ytaktiva medel, som ofta verkar vara toxiska, verkar interaktionen mellan katjoniska aminosyrasurfaktiva medel vara giftiga. Den katjoniska AAS är baserad på arginin, som spontant bildar stabila vesiklar i kombination med vissa anjoniska ytaktiva medel. Aminosyrabaserade korrosionshämmare rapporteras också vara giftiga. Dessa ytaktiva medel syntetiseras lätt med hög renhet (upp till 99%), låga kostnader, lätt biologiskt nedbrytbara och helt lösliga i vattenhaltiga medier. Flera studier har visat att svavelinnehållande ytaktiva aminosyror är överlägsna i korrosionsinhibering.
I en ny studie har Perinelli et al. rapporterade en tillfredsställande toxikologisk profil av rhamnolipider jämfört med konventionella ytaktiva medel. Rhamnolipider är kända för att fungera som permeabilitetsförstärkare. De rapporterade också effekten av rhamnolipider på epitelpermeabiliteten hos makromolekylära läkemedel.
08 Antimikrobiell aktivitet
Den antimikrobiella aktiviteten hos ytaktiva medel kan utvärderas genom den minsta hämmande koncentrationen. Den antimikrobiella aktiviteten hos argininbaserade ytaktiva medel har studerats i detalj. Gram-negativa bakterier visade sig vara mer resistenta mot argininbaserade ytaktiva medel än gram-positiva bakterier. Den antimikrobiella aktiviteten hos ytaktiva medel ökas vanligtvis genom närvaron av hydroxyl-, cyklopropan eller omättade bindningar inom acylkedjorna. Castillo et al. visade att längden på acylkedjorna och den positiva laddningen bestämmer HLB-värdet (hydrofil-lipofil balans) hos molekylen, och dessa påverkar deras förmåga att störa membran. Na-acylargininmetylester är en annan viktig klass av katjoniska ytaktiva medel med bredspektrum antimikrobiell aktivitet och det är lätt biologiskt nedbrytbart och har låg eller ingen toxicitet. Studies on the interaction of Nα-acylarginine methyl ester-based surfactants with 1,2-dipalmitoyl-sn-propyltrioxyl-3-phosphorylcholine and 1,2-ditetradecanoyl-sn-propyltrioxyl-3-phosphorylcholine, model membranes, and with living organisms in the presence or absence of external barriers have shown that this class of surfactants has Bra antimikrobiella resultaten visade att ytaktiva medel har god antibakteriell aktivitet.
09 reologiska egenskaper
De reologiska egenskaperna hos ytaktiva ämnen spelar en mycket viktig roll för att bestämma och förutsäga deras tillämpningar i olika branscher, inklusive mat, läkemedel, extraktion av olje, personlig vård och hemvårdsprodukter. Många studier har genomförts för att diskutera förhållandet mellan viskoelasticitet hos aminosyrasurfaktiva medel och CMC.
10 applikationer inom kosmetisk industri
AAS används i formuleringen av många produkter för personlig vård.Kalium-N-Cocoyl-glycinat visar sig vara mild på huden och används i ansiktsrengöring för att ta bort slam och smink. N-acyl-L-glutaminsyra har två karboxylgrupper, vilket gör den mer vattenlöslig. Bland dessa AAS används AAS baserat på C 12 -fettsyror i stor utsträckning i ansiktsrengöring för att ta bort slam och smink. AAS med en C 18-kedja används som emulgatorer i hudvårdsprodukter, och N-laurylalaninsalter är kända för att skapa krämiga skum som inte är irriterande för huden och kan därför användas i formuleringen av barnvårdsprodukter. N-laurylbaserade AA: er som används i tandkräm har god tvättståg som liknar tvål och starkt enzyminhiberande effektivitet.
Under de senaste decennierna har valet av ytaktiva medel för kosmetika, personliga vårdprodukter och läkemedel fokuserat på låg toxicitet, mildhet, mildhet till beröring och säkerhet. Konsumenter av dessa produkter är akut medvetna om potentiell irritation, toxicitet och miljöfaktorer.
Idag används AAS för att formulera många schampon, hårfärgningar och badsålar på grund av deras många fördelar jämfört med sina traditionella motsvarigheter inom kosmetika och personliga vårdprodukter.Proteinbaserade ytaktiva medel har önskvärda egenskaper som är nödvändiga för personliga vårdprodukter. Vissa AA: er har filmbildande kapacitet, medan andra har goda skumfunktioner.
Aminosyror är viktiga naturligt förekommande fuktgivande faktorer i stratum corneum. När epidermala celler dör blir de en del av stratum corneum och de intracellulära proteinerna gradvis bryts ned till aminosyror. Dessa aminosyror transporteras sedan längre in i stratum corneum, där de absorberar fett- eller fettliknande ämnen i epidermal stratum corneum och därigenom förbättrar elasticiteten i hudens yta. Cirka 50% av den naturliga fuktgivande faktorn i huden består av aminosyror och pyrrolidon.
Kollagen, en vanlig kosmetisk ingrediens, innehåller också aminosyror som håller huden mjuk.Hudproblem som grovhet och tråkighet beror till stor del på bristen på aminosyror. En studie visade att blandning av en aminosyra med en salva lindrade hudförbränningar, och de drabbade områdena återvände till sitt normala tillstånd utan att bli keloid ärr.
Aminosyror har också visat sig vara mycket användbara vid vård av skadade nagelband.Torrt, formlöst hår kan indikera en minskning av koncentrationen av aminosyror i ett allvarligt skadat stratum corneum. Aminosyror har förmågan att penetrera nagelbanden i håraxeln och absorbera fukt från huden.Denna förmåga hos aminosyrasbaserade ytaktiva medel gör dem mycket användbara i schampon, hårfärgämnen, hårmjukgörare, hårbalsam och närvaron av aminosyror gör håret starkt.
11 applikationer i vardagliga kosmetika
För närvarande finns det en växande efterfrågan på aminosyrasbaserade tvättmedelsformuleringar över hela världen.AAS är kända för att ha bättre rengöringsförmåga, skumförmåga och mjukgöringsegenskaper, vilket gör dem lämpliga för hushålls tvättmedel, schampon, kroppstvätt och andra applikationer.En asatsyra-härledd amfoterisk AAS rapporteras vara ett mycket effektivt tvättmedel med kelaterande egenskaper. Användningen av tvättmedelsingredienser bestående av N-alkyl-p-aminoetoxysyror visade sig minska hudirritation. En flytande tvättmedelsformulering bestående av N-kookoyl-p-aminopropionat har rapporterats vara ett effektivt tvättmedel för oljefläckar på metallytor. Ett aminokarboxylsyra-ytaktivt medel, C 14 Chohch 2 NHCH 2 Coona, har också visat sig ha bättre detergens och används för rengöring av textilier, mattor, hår, glas, etc. 2-hydroxi-3-aminopropionic acid-n, n-acetoacetics syra derivativ är känt för att ha god komplexa förmåga och således ger stattningsförmåga.
Beredningen av tvättmedelsformuleringar baserade på N- (N'-long-kedja acyl-p-alanyl) -p-alanin har rapporterats av Keigo och Tatsuya i deras patent för bättre tvättförmåga och stabilitet, enkelt skumbrytande och bra tygmjukning. Kao utvecklade en tvättmedelsformulering baserad på N-Acyl-1 -N-hydroxi-p-alanin och rapporterade låg hudirritation, hög vattenmotstånd och avlägsnande av hög fläck.
Det japanska företaget Ajinomoto använder låg-toxiska och lätt nedbrytbara AA: er baserade på L-glutaminsyra, L-arginin och L-lysin som huvudingredienser i schampon, tvättmedel och kosmetika (figur 13). Förmågan hos enzymtillsatser i tvättmedelsformuleringar att avlägsna proteinfouling har också rapporterats. N-acyl AA: er härrörande från glutaminsyra, alanin, metylglycin, serin och aspartinsyra har rapporterats för deras användning som utmärkta flytande tvättmedel i vattenhaltiga lösningar. Dessa ytaktiva medel ökar inte viskositeten alls, inte ens vid mycket låga temperaturer, och kan enkelt överföras från lagringskärlet på skumningsanordningen för att erhålla homogena skum.
Posttid: jun-09-2022

